Расчет коэффициентов активности. Личный опыт
Не так давно я вплотную столкнулся с расчетами коэффициента активности растворов
электролитов. Нельзя сказать, что раньше я никогда не производил таких расчетов,
однако сейчас у меня возникли некоторые вопросы, связанные с расчетами в области
высоких концентраций.
Известно, что до ионной силы 0,01 М коэффициент
активности (f) хорошо описывается
расширенной формулой Дебая-Хюккеля:
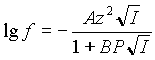
|
(1) |
где
z - заряд иона;
I - ионная сила раствора;
P - параметр Килланда, зависящий от размера иона;
A = 0,509 при 25 °С ;
B = 0,328 при 25 °С .
Ионная сила раствора равна
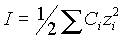
|
(2) |
где Ci - концентрация ионов одного вида в исследуемом растворе.
Для области большей ионной силы, самой
распространенной является следующая формула:
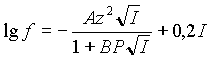
| (3) |
Эта формула предполагает увеличение
коэффициента активности после некоего значения
ионной силы.
Большинство исследователей предпочитают в своих работах не упоминать об условиях,
при которых следует от формулы (1) переходить к формуле (3). В связи с этим
я предпринял собственные исследования, благо в моем распоряжении была программа
IonCalc (Программу можно получить здесь.).
Поскольку я располагал справочными данными
("Краткий химический справочник"
В.А.Рабиновича и З.Я.Хавина, изд. "Химия",1977 г.)
об экспериментально полученных значениях
коэффициента активности, то работа состояла в
сопоставлении этих данных с расчет ными. Расчеты
я производил по формуле (1), так как применение
формулы (3) только усугубляло расхождение между
экспериментальными и расчетными данными.
В справочнике приведены экспериментально полученные данные о среднем коэффициенте
активности растворов солей. Средний коэффициент активности составляют коэффициенты
активности аниона и катиона следующим образом:
f срm+n = fMm
+ fAn , где
fM и fA - коэффициенты
активности катиона и аниона:
m и n - стехиометрические коэффициенты
исследуемой соли MmAn.
Если распоряжаться этой формулой, то можно легко рассчитать средний коэффициент
активности и сравнить его с экспериментальным.
Проведенные мной расчеты представлены в таблице, которая содержит сведения
об относительной разнице в процентах между экспериментальными и расчетными данными.
Относительная погрешность представлена в двух видах: среднеарифметическая величина
погрешности (первое число) и максимальная погрешность в серии расчетов (второе
число).
Таблица 1.*)
|
I, M
|
0,1
|
0,2
|
0,3
|
0,4
|
0,6
|
0,8
|
| MA 1) |
1,8/2,8
|
3,6/5,9
|
-
|
7,2/10
|
-
|
-
|
| MA2 2) |
-
|
-
|
2,8/5
|
-
|
5,8/7,5
|
-
|
| M2A 3) |
-
|
-
|
3,8/5,5
|
-
|
5,9/11
|
-
|
| MSO4 4) |
-
|
-
|
-
|
-
|
-
|
76/91
|
| LaCl3 |
-
|
-
|
-
|
-
|
16
|
-
|
| H3PO4 |
-
|
-
|
-
|
-
|
16
|
-
|
|
1) AgNO3 , HCl, HNO3 , KBr, KCl, KOH, NaCl, NaOH, NH4Cl,
NaCH3COO, NaNO3 , KNO3 .
2) BaCl2 , CaCl2 , FeCl2 , MgBr2 ,
MgCl2 , Ca(NO3)2 , Co(NO3)2 , Cu(NO3)2.
3) K2CrO4, K2SO4, Na2CrO4,
(NH4)2SO4, Na2SO4, Na2CO3,
K2CO3 .
4) ZnSO4, MgSO4, MnSO4, Cu SO4 .
Расчеты показывают, что для ионной силы в
0,3 М максимальная погрешность составляет 5-6%.
Необъясненным остается тот факт, что коэффициент активности сульфатов двухзарядных
металлов очень высок в сравнении с экспериментальными данными. Также высок средний
коэффициент активности серной кислоты. Он составляет 0,266 для раствора с ионной
силой 0,3 М, в то время как расчеты предоставляют величину 0,517.
*) На всякий случай хочу предупредить, что экспериментпльные результаты
в справочнике представлены в виде моляльных концентраций. Я не стал их переводить
в молярные, предполагая, что моляльность и молярность в растворах таких концентраций
примерно равна! |